Chứng khoán Rồng Việt vừa có báo cáo cập nhật triển vọng ngành dược trong đó nhấn mạnh đến cuộc chạy đua tiêu chuẩn EU-GMP của các doanh nghiệp.
Theo đó, thông thường các nhà máy sản xuất dược phẩm muốn đi vào hoạt động bắt buộc phải đáp ứng các tiêu chí của Bộ hướng dẫn thực hành sản xuất thuốc tốt (GMP – Good Manufacturing Practice) do cơ quan y tế của mỗi quốc gia thẩm định, cấp phép và giám sát (tại Việt Nam là Cục Quản lý dược thuộc Bộ Y Tế).
Hiện trong các tiêu chuẩn GMP phổ biến trong lĩnh vực sản xuất dược phẩm như ASEAN-GMP, WHO-GMP, EU-GMP, Japan-GMP, PIC/S-GMP, US FDA, tiêu chuẩn WHO-GMP là tiêu chuẩn phổ biến nhất tại Việt Nam. Tại thời điểm 11/10/2024, có 215 nhà máy đạt tiêu chuẩn WHO-GMP, chiếm 89,6% tổng số lượng nhà máy sản xuất dược phẩm tại Việt Nam (tiêu chuẩn ASEAN-GMP tuy dễ thực hiện hơn WHO-GMP nhưng đã không còn phổ biến nữa).
Tuy tiêu chuẩn WHO-GMP phổ biến nhưng hiện đã không còn là tiêu chuẩn đáng tin cậy do những quy định không chi tiết về các tiêu chí kỹ thuật. Ngoài ra, việc thẩm định và chứng nhận các nhà máy theo tiêu chuẩn WHO-GMP do cơ quan y tế mỗi nước tự áp dụng và hiệu chỉnh theo trình độ phát triển của từng nước. Do đó, cùng một tiêu chuẩn WHO-GMP, các tiêu chuẩn đánh giá và thẩm định thường không đồng nhất.
Nhiều doanh nghiệp sản xuất dược phẩm Việt Nam hiện đang tập trung cho việc lấy chứng nhận đạt các tiêu chuẩn quốc tế ở mức cao hơn như EU-GMP, Japan-GMP, PIC/S-GMP hoặc US FDA cho các sản phẩm của mình do sự vượt trội mà các tiêu chuẩn này mang lại.
Nhìn chung, tiêu chuẩn EU-GMP đặt ra những quy tắc, tiêu chuẩn mang tính bảo vệ người tiêu dùng, bảo vệ công nhân sản xuất, bảo vệ môi trường cao hơn cũng như đảm bảo tính chuẩn tắc và tuân thủ nghiêm ngặt hơn
Việc thực hiện chuẩn EU-GMP tuy mang lại nhiều lợi ích nhưng cũng đặt ra những thách thức để có thể đạt được chuẩn này.
Các sản phẩm được sản xuất theo các tiêu chuẩn EU-GMP hoặc tương đương được phép lưu hành ngoài biên giới quốc gia (xuất khẩu); Sản phẩm sản xuất đạt tiêu chuẩn EU-GMP hoặc tương đương có chất lượng cao, hỗ trợ nâng cao định vị thương hiệu của các doanh nghiệp, qua đó cũng thúc đẩy doanh thu kênh OTC.
Với chiến lược dài hạn nâng cấp tiêu chuẩn sản xuất dược phẩm trong nước của Chính phủ và Bộ Y tế, việc “nâng chuẩn” trở thành cuộc đua của nhiều doanh nghiệp sản xuất dược phẩm trong nước.
Cụ thể, theo Luật đấu thầu 2023 ban hành ngày 23/6/2023, hiệu lực thi hành từ ngày 1/1/2024, Điều 56, Khoản 1b có quy định như sau: “Đối với thuốc được Bộ Y Tế công bố có ít nhất 03 hãng sản xuất trong nước sản xuất trên dây chuyền sản xuất thuốc đáp ứng nguyên tắc, tiêu chuẩn EU-GMP hoặc tương đương EU-GMP và đáp ứng tiêu chí kỹ thuật theo quy định của Bộ Y tế và về chất lượng, giá, khả năng cung cấp thì trong hồ sơ mời thầu, hồ sơ yêu cầu phải quy định nhà thầu chỉ chào thầu thuốc xuất xứ trong nước.”
Thuốc được sản xuất theo tiêu chuẩn càng cao sẽ được phân vào nhóm thuốc càng cao, nhờ đó cho doanh thu/lợi nhuận có thể cao hơn 3 lần so với thuốc trúng thầu các nhóm thấp hơn.
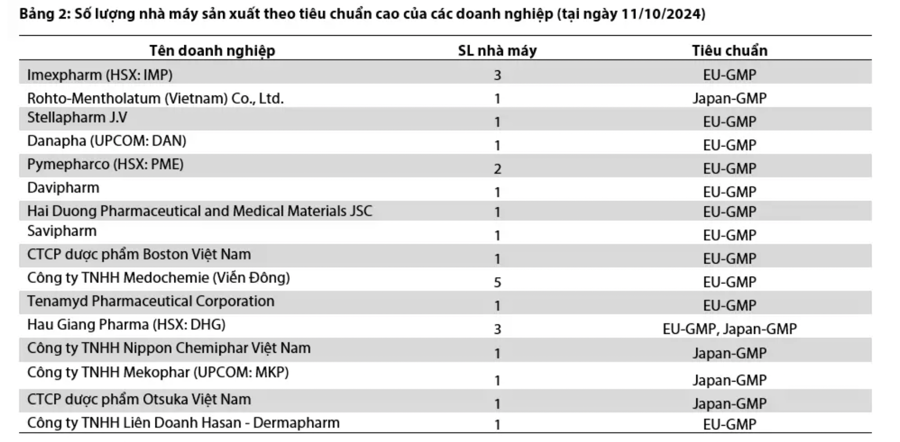
Thực tế, từ cuối năm 2020 đến tháng 10 năm 2024, cả số lượng nhà máy và tỷ lệ nhà máy đạt tiêu chuẩn cao (EU-GMP, Japan-GMP, PIC-S/GMP) đã tăng đáng kể
Tại ngày 11/10/2024, có 25/240 tổng số nhà máy sản xuất dược phẩm tại Việt Nam (chiếm 10,4%) đạt được một trong các chuẩn cao (EU-GMP, PIC/S-GMP, Japan-GMP, US FDA). Trong số 25 nhà máy thuộc về 16 doanh nghiệp này, Medochemie (Viễn Đông) sở hữu số lượng nhà máy đạt chuẩn cao nhiều nhất. Tuy nhiên, trong số các doanh nghiệp niêm yết trên sàn chứng khoán, Imexpharm (HSX:IMP) hiện có số lượng dây chuyền sản xuất đạt chuẩn cao nhiều nhất với 12 dây chuyền sản xuất tại 3 nhà máy đạt chuẩn EU-GMP.
Các doanh nghiệp đã có sẵn dây chuyền sản xuất theo chuẩn EU-GMP hoặc tương đương sẽ có tiềm năng tăng trường tốt hơn. Thuốc được sản xuất dưới tiêu chuẩn càng cao sẽ cho doanh thu/lợi nhuận tốt hơn so với thuốc được sản xuất với tiêu chuẩn thấp hơn.
Ngoài ra, việc đặt tiêu chuẩn EU-GMP cũng mang lại lợi thế khi đấu thầu kênh ETC. Trong khi đó, theo BMI, tỷ trọng doanh thu kênh ETC sẽ tăng từ 76,1% năm 2023 lên 77,4% năm 2028 nhờ vào: định hướng của Chính phủ mở rộng độ bao phủ bảo hiểm y tế; và cơ sở vật chất và dịch vụ của bệnh viện công và bệnh viện tư ngày càng được cải thiện.
Do đó, việc được ưu tiên đấu thầu ở nhóm thuốc cao ở kênh ETC sẽ tạo động lực tăng trưởng tốt hơn cho các doanh nghiệp dược phẩm.
Theo đó, trong các doanh nghiệp niêm yết, các doanh nghiệp sau sẽ có lợi thế cạnh tranh, bao gồm: IMP, DHG, PME. Ngoài ra, DBD là doanh nghiệp đã và đang theo đuổi nhiều dự án nâng chuẩn EU-GMP, DHT hiện cũng đã xây dựng xong nhà máy dược phẩm mới tại KCN cao Hòa Lạc (Hà Nội) theo tiêu chuẩn Japan-GMP và đang chờ thẩm định. Nếu những dự án này được hiện thực hóa cũng sẽ tạo lợi thế cạnh tranh và động lực tăng trưởng mới cho các doanh nghiệp.






 Google translate
Google translate