Đối với việc sản xuất vaccine, Chính phủ đã công bố rất rõ ràng, cần tập trung đầu tư, hỗ trợ, tháo gỡ vướng mắc, thúc đẩy nghiên cứu, sản xuất vaccine trong nước để chủ động nguồn cung và giá thành phù hợp hơn. Vậy mà đến bây giờ, chưa có một loại vaccine nội nào xuất hiện. Bên lề cuộc họp Quốc hội, ông Nguyễn Hoàng Mai, Phó Chủ nhiệm Ủy ban Xã hội của Quốc hội, cho biết: “Dịch bùng phát đã gây nỗi lo lắng cho người dân nhưng việc sản xuất vaccine trong nước đến nay chưa đạt kỳ vọng”.
VACCINE NỘI GẶP "KHÓ" VẪN CHƯA "LÓ" CÁI KHÔN
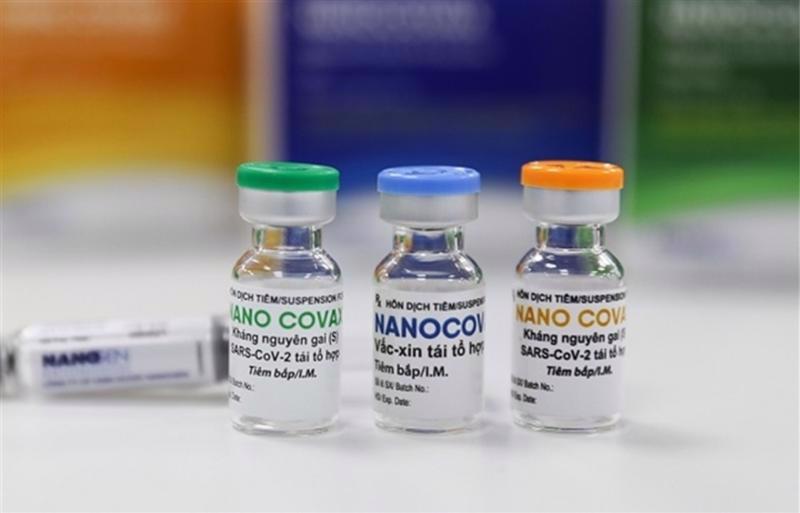
Tính đến thời điểm này, Việt Nam hiện có năm loại vaccine nội theo ba dạng: nghiên cứu sản xuất trong nước, chuyển giao công nghệ và đóng gói thành phẩm. Trong đó, hai loại tự nghiên cứu sản xuất trong nước là vaccine Nanocovax của Công ty cổ phần Công nghệ sinh học dược Nanogen (Nanogen) và vaccine Covivac của Viện Vắc xin và sinh phẩm y tế (IVAC) Nha Trang.
Còn lại ba loại vaccine thì có 2 loại thuộc dạng chuyển giao công nghệ gồm: vaccine ARCT-154 của Công ty cổ phần công nghệ Sinh học VinBioCare đã bước vào giai đoạn 3b; vaccine Hippra (do Tây Ban Nha phát triển chuyển giao công nghệ cho Tập đoàn T&T Group ) - hiện vẫn chưa triển khai tiếp vì chưa tìm được địa phương triển khai đúng theo quy định nghiên cứu hiện hành; Vaccine Sputnik V của Nga do Vabiotech nhận gia công đóng ống tại Việt Nam, đã sản xuất lô vaccine thương mại với khoảng 1 triệu liều sẵn sàng xuất xưởng.
Vaccine Nanocovax được xem là có triển vọng nhất và đã được Hội đồng Đạo đức trong nghiên cứu Y Sinh học Quốc gia (Hội đồng Đạo đức) lần thứ hai thông qua báo cáo giữa kỳ thử nghiệm giai đoạn ba của nhóm nghiên cứu vaccine vào ngày 18/9/2021. Báo cáo này đã được Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc và nguyên liệu làm thuốc tiến hành họp xem xét hôm 22/10/2021, nhưng đến nay vẫn chưa có một thông tin công khai gì thêm về loại vaccine nội này.
Còn vaccine Covivac của Viện Vắc xin và sinh phẩm y tế (IVAC) Nha Trang phát triển đang dự kiến thử nghiệm giai đoạn 3 với 4.000 người tham gia vào tháng 12/2021. Thế nhưng, để có đủ 4.000 người tham gia thử nghiệm chưa tiêm vaccine nào trong điều kiện hiện nay là rất khó. Tương tự, đối với vaccine Hippra, khó khăn chưa triển khai được vẫn là khó tìm người chưa tiêm mũi nào. Đơn giản, bởi tính đến ngày 9/11/2021 Việt Nam đã có gần 94 triệu liều vaccine được tiêm và số mũi tiêm sẽ ngày càng tăng hơn.
Nhìn vào 5 loại vaccine nội trên, cho thấy dù Chính phủ đã hỗ trợ, tháo gỡ vướng mắc, thúc đẩy nghiên cứu, sản xuất vaccine nhưng vẫn chưa đạt như kỳ vọng. Kỳ vọng nhất là Nanocovax và Sputnik V vẫn đang chờ được cấp phép khẩn cấp (do chưa có dữ liệu để đánh giá trực tiếp hiệu lực bảo vệ). Ba loại kia chỉ mới đang ở giai đoạn thử nghiệm lâm sàng 2-3, còn chưa đủ dữ liệu hiệu quả 2 mũi tiêm cơ bản.
Theo một nghiên cứu của ngành y - dược, sản xuất vaccine là một ngành chứa rất nhiều rủi ro và cần một lượng vốn ban đầu rất lớn. Tỷ lệ thất bại của nghiên cứu vaccine lên đến 94%, có nghĩa là chỉ có 6% ứng viên vaccine vượt qua giai đoạn kiểm nghiệm lâm sàng lần 3. Còn chi phí cho một loại vaccine lên đến hàng tỷ đô la, cao hơn rất nhiều so với việc bào chế thuốc thông thường. Làm sao có đủ dữ liệu đã trở thành cái khó, nhưng vẫn chưa “ló” cái khôn để thúc đẩy sản xuất vaccine trong nước.
GỠ RÀO CẢN BẰNG NHỮNG QUY ĐỊNH HỢP LÝ
Với những khó khăn khi thử nghiệm lâm sàng trong thực tế hiện nay, đối với từng loại vaccine như đã nói trên cho thấy, các vaccine nội khó có thể tiến hành những bước tiếp theo. Hồ sơ báo cáo của Nanocovax được nhóm nghiên cứu làm bài bản, công phu nhưng vẫn thiếu dữ liệu thực tế nên còn nằm đó chưa được cấp phép khẩn cấp. Còn các loại vaccine khác thì cơ hội để họ tiếp tục thử nghiệm sản xuất phục vụ tiêm các mũi tăng cường, tiêm bổ sung, nghiên cứu sản xuất vaccine cho trẻ em cũng đang bị chặn lại vì không có dữ liệu thực tế của giai đoạn 2, 3. Chưa kể mất luôn cơ hội tham gia vào thị trường vaccine thế giới…

Rào cản nào đã ngăn cản việc cấp phép khẩn cấp cho vaccine cũng như có thể tước đi cơ hội để vaccine nội tiếp tục các bước nghiên cứu tiếp theo? Một số chuyên gia y tế đã chỉ ra rào cản này, đó chính là các quy định buộc các nhà sản xuất vaccine phải có đủ dữ liệu lâm sàng mũi tiêm cơ bản mới được chuyển sang thử nghiệm liều bổ sung. Trong khi đó, các nước ở châu Âu, vaccine Covid-19 thử nghiệm lâm sàng xong giai đoạn 1, có thể chuyển sang thử nghiệm mũi tiêm bổ sung.
Vaccine phải có đầy đủ dữ liệu để đánh giá trực tiếp hiệu lực bảo vệ của vaccine theo đề cương nghiên cứu đã trở thành cái khó khi muốn cấp phép khẩn cấp. Thực tế, không có vaccine nào có kết quả như vậy trong tình trạng khẩn cấp. Đó là lý do một số nước chấp nhận kết quả ước tính theo lý thuyết hiệu lực bảo vệ để cấp phép khẩn cấp có điều kiện. Điều này, cũng như một số nhà nghiên cứu khác, theo PGS.TS. Đỗ Văn Dũng - Trưởng khoa Y tế công cộng Trường Đại học Y dược TP.HCM: “Thử nghiệm theo phương pháp cũ, chọn người chưa tiêm vaccine gần như không thể vì đa phần đều được khuyến cáo tiêm ngừa càng sớm càng tốt, trừ một số trường hợp trì hoãn do bệnh lý. Tuy nhiên, ngoài phương pháp này, hiện khoa học cũng cho phép đánh giá tính sinh miễn dịch nhằm suy ra hiệu lực vaccine”. Vì thế, nhóm nghiên cứu đã tính toán theo lý thuyết vaccine Nanocovax cho kết quả hiệu quả bảo vệ đạt yêu cầu giống như các vaccine ngoại đã được cấp phép ở Việt Nam.
Do đó, muốn thúc đẩy sự phát triển của vaccine nội, thiết nghĩ Bộ Y tế không những giảm bớt rút ngắn các thủ tục cấp phép, mà còn phải xem xét đưa ra các quy định rõ ràng, minh bạch vừa đáp ứng đủ điều kiện khoa học vừa phù hợp thực tế để vaccine được phê duyệt sản xuất, cung ứng. Bằng cách nào đó, gỡ rào cản này thì vaccine nội mới có cơ hội tham gia vào thị trường vaccine. Ngoài ra, Bộ Y tế cần phải có cơ chế ủng hộ, tạo niềm tin cho các đơn vị sản xuất vaccine trong nước, bởi nếu không có họ việc chống dịch về lâu dài sẽ vô cùng khó khăn. Tất nhiên các nhà sản xuất cũng phải tích cực thực hiện các nghiên cứu, thử nghiệm nghiêm túc đáp ứng yêu cầu của các hội đồng quốc gia

















 Google translate
Google translate